UNIDAD I
ESTEQUIOMETRÍA
Como estudiantes, es fundamental identificar con claridad estas reglas y aplicarlas adecuadamente en las diversas situaciones que se presenten durante su formación profesional.
RECURSOS
Volumen molar y ley general de los gases
La siguiente actividad tienen el propósito de reafirmar los principales aspectos referentes a este tema o bien que identifiques aquellas situaciones que no puedas resolver adecuadamente y consultes con el profesor cualquier duda al respecto.
Es recomendable que puedas desarrollar esta actividad con anticipación al primer examen parcial ya que esta actividad es también una guía de estudio.

Para consultar la actividad
Da un click aquí
GUÍA DE ESTUDIO PARA EL EXAMEN ORDINARIO
ESTEQUIMETRIA
da un click aquí
ESTEQUIOMETRÍA
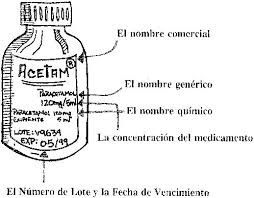
Nomenclatura química
Introducción
En la vida cotidiana nos comunicamos de diversas formas, desde el lenguaje hablado y escrito convencional, hasta los diversos códigos y convencionalismos que se dan entre diversos grupos o comunidades. La Química no tendría por que ser la excepción, los químicos han generado a lo largo de la historia diversos sistemas a través de los cuales han definido diversas reglas de nomenclatura, para escribir y nombrar adecuadamente a los compuestos químicos.
Como estudiantes, es fundamental identificar con claridad estas reglas y aplicarlas adecuadamente en las diversas situaciones que se presenten durante su formación profesional.
RECURSOS
Para cubrir los objetivos de este curso, se han seleccionado dos recursos que deberás leer y analizar cuidadosamente
- El primero, que podrás consultar al dar un click aquí, es una versión sintética que te ofrece los principales criterios para el estudio de la nomenclatura
- El segundo que podrás revisar al dar un click en este lugar, incluye elementos revisados a mayor profundidad y que te sugerimos revises con detenimiento.
ACTIVIDAD
Abre el siguiente espacio y resuelve la actividad de acuerdo a las instrucciones que aparecen al inicio de la misma.
FECHA DE ENTREGA
sábado
sábado
TAREA
(actividad complementaria)
Revisión bibliográfica
El siguiente texto, se encuentra en la biblioteca de Campus II.
Hein, M., Arena, S. 2001. "Fundamentos d Química" Internacional Thomson Editores, Mex. Décima edición. Capítulo 2. Estándares de medición, pp 10 a 42.
Elaborar un resumen de este capítulo de acuerdo las siguientes características:
Se entregará en hojas blancas, sin carátula, sin fólder, en la primera hoja como encabezado indicar nombre de alumno y grupo, terminado el resumen las cuartillas se deberán engrapar para su entrega. El tipo de letra será Arial-11 e interlineado sencillo.
Fecha de entrega: Sábado
La siguiente actividad tienen el propósito de reafirmar los principales aspectos referentes a este tema o bien que identifiques aquellas situaciones que no puedas resolver adecuadamente y consultes con el profesor cualquier duda al respecto.
Es recomendable que puedas desarrollar esta actividad con anticipación al primer examen parcial ya que esta actividad es también una guía de estudio.
Para consultar la actividad
Da un click aquí
ESTEQUIMETRIA
da un click aquí
UNIDAD II
TERMOQUÍMICA
TERMOQUÍMICA
- La actividad que se presenta en este bloque (glosario), a la cual puedes acceder dando un Click aquí, tiene como propósito servir de guía y contribuir a la evaluación de la parte teórica de esta unidad.
- Para elaborar este glosario, podrás hacer una revisión convencional en libros impresos de química general o a través de la Web. Recuerda que lo realmente importante es que estudies estos aspectos.
- Una vez terminado el glosario, deberás estudiarlo con detalle y en forma autoregulada (esto es sin consultar el documento o consultar a otros compañeros) contestar el siguiente cuestionario solo una vez. Recuerda que en este momento no es determinante la calificación, sino el aprendizaje que puedas obtener.
Al terminar esta etapa, podrás resolver los ejercicios que se presentan en esta sección que puedes descargar desde aquí. Es muy importante que los resuelvas ya que la siguiente autoevaluación requerirá que los hayas practicado y razonado adecuadamente.
Tema: Energías de enlace
Para el desarrollo de esta etapa, contarás con unas serie de apoyos que iremos construyendo gradualmente a partir de la fecha de inicio.
Para el desarrollo de esta etapa, contarás con unas serie de apoyos que iremos construyendo gradualmente a partir de la fecha de inicio.
Analiza cuidadosamente el siguiente documento y en tu cuaderno de de notas, resuelve los ejercicios que se indican.

Tema: Calorimetría. 1
Analiza cuidadosamente el siguiente documento y en tu cuaderno de de notas, resuelve los ejercicios que se indican.

Tema: Calorimetría. 1
Analiza cuidadosamente el siguiente documento y en tu cuaderno de de notas, resuelve los ejercicios que se indican.
Tema: Calorimetría. 2
- La semana pasada revisamos algunos fundamentos sobre el tema "Calorimetría" y establecimos algunos aspectos importantes.
- Iniciemos esta semana, reafirmando nuestro conocimiento al respecto y para ello analicemos con cuidado los principios que orientan el funcionamiento de un calorímetro "tipo bomba" analizando cuidadosamente el siguiente recurso que podrás consultar dando un click en la imagen del calorímetro.
- Dediquemos un tiempo a esto y en unas horas pasaremos a los ejercicios.
- Revisa con atención el siguiente video para reafirmar los contenidos expresados en el recurso anterior.
Calorimetría. 3 (ejercicios)
Como lo hicimos notar en su momento, la variación de calor de una reacción (∆H°) se puede obtener por diversas formas o métodos. Hemos revisado el empleo de los valores de energías de enlace promedio y el empleo del método calorimétrico. Pasemos ahora al estudio de una tercera alternativa que da título a este tema, para revisarlo da un click en la imagen
Tema:
Calculo de la Energía Libre de Gibbs.
Hemos terminado, habiendo hecho la revisión anterior, pasemos a reafirmar aspectos importantes, analicemos un ejemplo comentado y hagamos dos sencillo ejercicios. Consulta esta última sección
- Concluiremos esta sección de calorimetría resolviendo los ejercicios que se presentan a continuación, dando un click en la siguiente imagen
- La fecha de entrega será el 6 de agosto
Atiendan cuidadosamente las instrucciones. Hago énfasis en que los equipos de trabajo son los que se formaron en el aula virtual (son los equipos del trabajo de revisión bibliográfica)
Tema:
Empleo de valores de Entalpías estándar de formación de compuestos (∆H°f) para el calculo de ∆H°de una reacción.
Tema:
Segunda Ley de la Termodinámica y espontaneidad de los procesos
Pasamos al último tema de esta unidad. Aquí estudiaremos los aspectos fundamentales asociados a la 2° Ley de la Termodinámica, centrando nuestra atención en los conceptos de: entropía, espontaneidad de los procesos y la temperatura absoluta.
- Nos apoyaremos en el trabajo realizado por sus compañeros de grupo y posteriormente pasaremos a realizar algunos ejercicios.
- Como comentario adicional, recuerden que en cursos mas avanzados estudiaran a mayor profundidad lo relacionado a las máquinas térmicas
Hemos terminado, habiendo hecho la revisión anterior, pasemos a reafirmar aspectos importantes, analicemos un ejemplo comentado y hagamos dos sencillo ejercicios. Consulta esta última sección
Gracias por su participación, recurden que mañana sábado haremos una sencilla autoevaluación. Estén atentos en esta misma sección
Accede a la evaluación
Accede a la evaluación
UNIDAD III
Equilibrios iónicos en solución acuosa

Consulta el material bibliográfico que se encuentra en el siguiente vínculo


Tema 2. La molécula de agua. Importancia en la explicación del comportamiento iónico de los solutos
video
UNIDAD III
Segunda parte

Recurso 1. Lecturas
Descarga la siguiente tabla de potenciales estándar de media celda como apoyo para la revisión del siguiente tema (video)
Potenciales de reducción estandar
Espontaneidad y reacciones redox
Ecuación de Nernst
Utilizando la Ecuación de Nernst
Equilibrios iónicos en solución acuosa
Tema 1. Fundamentos
Actividad 1
Instrucciones:
- Se llevará a cabo una lectura individual desde el inicio y hasta la página 143 del documento.
- Los integrantes del grupo se pondrán en contacto y formarán entre ellos equipos de cuatro a cinco integrantes. Una vez organizados, elaborarán como equipo una cuartilla en la que se incluyan 15 aspectos que consideren sobresalientes del tema revisado en la lectura.
- El documento elaborado por el equipo, será enviado por el representante del mismo a mi correo en formato PDF con letra tipo Arial -14 e interlineado de 1.5
- Fecha de entrega: 30 de julio 2021
Actividad 2
Instrucciones:
- El cuestionario que se encuentra después de estas instrucciones se resolverá por equipo. Recurran a diversas fuentes de búsqueda para contestar cada una de las preguntas.
- El documento elaborado por el equipo, será enviado por el representante del mismo a mi correo en formato PDF con letra tipo Arial -12 e interlineado de 1.5
- Fecha de entrega : 30 de julio 2021
CUESTIONARIO
- ¿Cómo se define el equilibrio químico?
- Explica cada una de las siguientes características del equilibrio químico: naturaleza dinámica, no se cumple estrictamente la estequiometría de la reacción, depende de la presión, la temperatura o cambios de concentración.
- ¿A qué se refiere la Ley de Acción de Masas?
- ¿Cómo se expresa matemáticamente la constante de equilibrio (Kc)?
- ¿Qué significado físico tienen las relaciones Kc>1 y Kc<1?
- ¿Cómo se definen las sustancias electrolíticas y las no electrolíticas?
- Explique las pruebas de Arrhenius en relación a la existencia de los iones: eléctricas, físicas y químicas.
- Copie un esquema tridimensional de la molécula de agua que muestre claramente su estructura tetraédrica
- Defina el concepto de polaridad y explique el efecto de la electronegatividad del oxígeno y el hidrógeno y el efecto de los pares de electrones no enlazantes del oxígeno sobre la geometría y la polaridad de la molécula de agua.
- Explique como se forman y cuál es el efecto de los puentes de hidrógeno en el agua.
- ¿Cómo explica la autoionización del agua?
- ¿A qué se refiere el Principio de L´Chatalier?
- ¿Cuál es la escala de pH y en qué se fundamenta?
- ¿Cómo se define un “protón” en la Teoría de Bronsted – Lowry?
- ¿Qué es un ácido de Bronsted – Lowry?
- ¿Qué es una base de Bronsted – Lowry?
- ¿A qué se le llama pareja conjugada de Bronsted – Lowry?
- ¿Qué caracteriza a un ácido y a una base fuertes?
- ¿Qué caracteriza a un ácido y a una base débiles?
- ¿Cómo se forman las sales ácidas y básicas?
Tema 2. La molécula de agua. Importancia en la explicación del comportamiento iónico de los solutos
Revisa con detenimiento los siguientes recursos.
video
Evaluación del componente teórico.
Da un clic en la imagen para acceder a la prueba, esta será la última evaluación que haremos en el curso, puedes acceder a ella y contestarla, en el momento que lo consideres conveniente
Tema 1. Algunas implicaciones del equilibrio químico
La revisión bibliográfica realizada por cada uno de los equipos, es la base teórica mínima necesaria para esta unidad que además nos permitirá entender mejor la parte práctica.
Iniciemos esta etapa con dos actividades muy sencillas pero fundamentales para comprender y avanzar de manera más ágil, a las cuales puedes acceder dando un clic en la siguiente imagen
Tema 2.1 Recursos de apoyo al auto aprendizaje
En esta sección encontrarás algunos recursos elaborados ex profeso para reforzar los contenidos teóricos revisados, son importantes ya que operan como enlace para que podamos pasar a la resolución de ejercicios de manera formal.
Autoionización del agua. pH y pOH
Modificación del equilibrio iónico del agua. Efecto por cambios de concentración
Tema 2. 2 Videos de apoyo al autoaprendizaje
En esta sección encontrarás 5 videos tomados de Youtube. Para su uso en este Blog respetamos los derechos del autor Yamil Cordoba Moreno y los empleamos únicamente con fines didácticos y de aprendizaje. Estos videos, al igual que los recursos anteriores, son importantes ya que operan como enlace para que podamos pasar a la resolución de ejercicios de manera formal.
VIDEO 1
La escala de pH
VIDEO 2
Fuerza de los ácidos y las bases
VIDEO 3
Ácidos y bases de Bronsted - Lowry
VIDEO 4
Pares ácido - base conjugados
VIDEO 5
Constante de disociación Ka y Kw
Retroalimentación de la parte práctica
Haremos una retroalimentación de los ejercicios resueltos por equipo. Iniciamos con la primera parte (Actividad 1) para ello consulten los siguientes recursos y sigan las recomendaciones.
Recurso 1
Recurso 2

Pasemos a revisar el Actividad 2, agrego para ello una breve retroalimentación (recurso 1) y la actividad enviada por uno de los equipos del semestre anterior que considero cumple al 100% con los criterios solicitados (recurso 2)
Recurso 1
Recurso 2
Recurso 1
Recurso 2

Pasemos a revisar el Actividad 2, agrego para ello una breve retroalimentación (recurso 1) y la actividad enviada por uno de los equipos del semestre anterior que considero cumple al 100% con los criterios solicitados (recurso 2)
Recurso 1
Recurso 2
Segunda parte
Este tema, resulta del mayor interés ya que recupera aspectos aprendidos en etapas anteriores: procesos redox, espontaneidad de los procesos y efecto de los cambios de concentración en un equilibrio.
Revisaremos el tema durante la semana, para lo cual se proporcionan algunos recursos que les permitirán el final de la semana resolver una sencilla evaluación.
La evaluación esta cerrada
Recurso 1. Lecturas
El siguiente recurso te permitirá entender mejor la temática, estudia cuidadosamente el contenido y elabora una guía de estudio.
Recurso 2. Videos
Celdas electroquímicas
Descarga la siguiente tabla de potenciales estándar de media celda como apoyo para la revisión del siguiente tema (video)
Potenciales de reducción estandar
Espontaneidad y reacciones redox
Ecuación de Nernst
Utilizando la Ecuación de Nernst
Actividad
Cada equipo resolverá esta actividad y la enviará por correo, de la forma acostumbrada a mas tardar el lunes 2 de agosto del 2021. Dado que el archivo es PDF, solicito que lo pasen a Word y una vez resuelto conviertan nuevamente a PDF para enviarlo.
Apoyo a la docencia
(periodo de contingencia)
DA UN CLICK AQUÍ
DA UN CLICK AQUÍ
(periodo de contingencia)
TEORÍA ATÓMICA
UNIDAD IV
En la última semana del curso, revisaremos el tema de "Teoría atómica". Esta unidad, por su naturaleza es fundamentalmente teórica. Es por ello que para abordarla se ofrecen un conjunto de recursos a través de los cuales podrán explorar y aprender los aspectos mas importantes vinculados a este importante periodo de la Física moderna.
1. Estructura electrónica de la materia
DA UN CLICK AQUÍ
2. Química cuántica
DA UN CLICK AQUÍ
3. Se incluye el siguiente material, debes revisarlo con atención para una mejor compensión del tema
4. Hipótesis Cuántica de Planck
5. En el siguiente documento podrás revisar en detalle los fundamentos matemáticos establecidos por los físicos para explicar la mecánica del átomo.
Entrega por equipo un documento en el que expresen en un mínimo de cuatro cuartillas, un resumen con los aspectos mas sobresalientes de los temas tratados en los recursos previos. Fecha de entrega impostergable (envío en la forma acostumbrada) será el lunes 2 de agosto del 2021
Actividad (a modo de evaluación)
Actividad 3
Resuelve los siguientes
EJERCICIOS
EJERCICIOS
Recursos adicionales
1. Presentación power point
1. Presentación power point
Se incorpora la presentación "Concepto de pH, fundamentos e importancia" para contribuir a los objetivos de esta parte de la unidad III
2. Videos educativos
En el siguiente bloque, se presentan los videos elaborados por algunos compañeros de los grupos 3155 y 3156 de la Carrera de QFB, Has una revisión cuidadosa de los mismos y recupera aquellos aspectos que refuercen tu conocimiento.
La molécula de agua
Autoionización del agua
Equilibrio químico
Ácidos y bases. Teoría de Bronsted- Lowry
3. Lecturas de apoyo complementarias
Te recomiendo que des lectura a por lo menos una de las siguientes sugerencias bibliográficas para reforzar los contenidos revisados en clase y tengas mayores elementos para la presentación del cuarto examen parcial.
- American Chemical Society (2005). Química. Un proyecto de la American Chemical Society. Ed. Reverté. España, pags. 212.269
- Whitten, K., Davis, R., Peck, M. L., Stanley, G. (2009) Química. CENGAGE, Lerning. México, pags. 166-233
- Mahan, B., H. (1977) . Química. Curso Universitario. Fondo Educativo Interamericano, pags. 397-450
Estructura electrónica de la materia.
DA UN CLICK AQUÍ
Química cuántica.
DA UN CLICK AQUÍ
3. Se incluye el siguiente material, debes revisarlo con atención.
5. En el siguiente documento podrás revisar en detalle los fundamentos matemáticos establecidos por los físicos para explicar la mecánica del átomo




Buenas noches, profesor. Las calificaciones finales se subirán al grupo, o las dará el Lunes 11?
ResponderBorrar